Protezione catodica
1. La corrosione dei metalli
La corrosione dei metalli è un fenomeno fisico-chimico che avviene con degradazione di uno o più metalli in contatto con un certo ambiente e che comporta la presenza simultanea di due reazioni, una an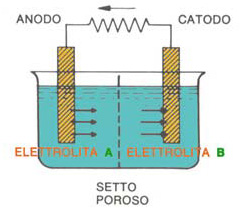 odica di ossidazione e una catodica di riduzione.
odica di ossidazione e una catodica di riduzione.
Quando un metallo è a contatto con un elettrolita (acqua, terreno, umidità, ecc.) assume un potenziale elettrico determinato dalle reazioni chimiche citate ed il cui valore dipende dal metallo e dall'elettrolita. Due metalli diversi a contatto elettrico fra loro e immersi in un elettrolita, assumendo due diversi valori di potenziale, provocano il flusso di una corrente elettrica spontanea che tende a condurre i potenziali naturali dei metalli verso uno stesso valore detto potenziale di corrosione o misto. La circolazione di corrente nel metallo avviene a livello elettronico, mentre nell’elettrolita avviene mediante migrazione ionica connessa con le reazioni di ossidoriduzione e pertanto con disgregazione del metallo il cui potenziale è più anodico.
2. La protezione catodica
Fornendo alla coppia di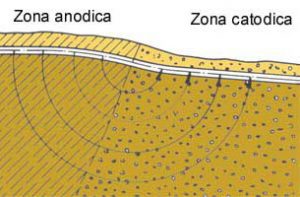 metalli presa in considerazione al punto precedente una corrente elettrica esterna, provochiamo una variazione del potenziale misto introducendo forzatamente una sovratensione. È dimostrabile che, se questa sovratensione è tale da provocare una diminuzione del potenziale misto fino ad un valore inferiore al potenziale del metallo più anodico, non può più avvenire la reazione di corrosione. Su questo concetto, scoperto nel 1824 da Humphry Davy, si basa la protezione catodica, che consiste appunto nel rendere la superficie di un metallo da proteggere più elettronegativa di quello che è il suo potenziale di ossidoriduzione in un determinato elettrolita. Naturalmente la corrente deve essere fornita realizzando un circuito in grado di far circolare la corrente nell’elettrolita con scambio ionico alimentato da una reazione di ossidazione. In altre parole, non sarà sufficiente disporre di un generatore di corrente elettrica continua, ma sarà necessario inserire nel circuito anche un elemento sacrificabile su cui possa avvenire la reazione di ossidazione.
metalli presa in considerazione al punto precedente una corrente elettrica esterna, provochiamo una variazione del potenziale misto introducendo forzatamente una sovratensione. È dimostrabile che, se questa sovratensione è tale da provocare una diminuzione del potenziale misto fino ad un valore inferiore al potenziale del metallo più anodico, non può più avvenire la reazione di corrosione. Su questo concetto, scoperto nel 1824 da Humphry Davy, si basa la protezione catodica, che consiste appunto nel rendere la superficie di un metallo da proteggere più elettronegativa di quello che è il suo potenziale di ossidoriduzione in un determinato elettrolita. Naturalmente la corrente deve essere fornita realizzando un circuito in grado di far circolare la corrente nell’elettrolita con scambio ionico alimentato da una reazione di ossidazione. In altre parole, non sarà sufficiente disporre di un generatore di corrente elettrica continua, ma sarà necessario inserire nel circuito anche un elemento sacrificabile su cui possa avvenire la reazione di ossidazione.
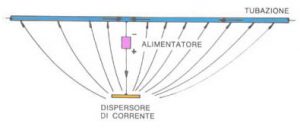
3. Protezione catodica con alimentatori
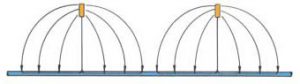
In questo caso la corrente elettrica viene fornita da un alimentatore costituito essenzialmente da un trasformatore e da un raddrizzatore di corrente. Al polo negativo nell’alimentatore è collegata la struttura metallica da proteggere, mentre al polo positivo viene collegato il «dispersore» che ha lo scopo di assicurare la corrente nell’elettrolita. Il dispersore ovviamente dovrà essere posato nello stesso ambiente in cui si trova la struttura da proteggere.
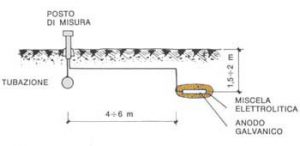
4. Protezione catodica con anodi galvanici
Questo metodo sfrutta la corrente stessa di corrosione per ottenere un potenziale di protezione per la struttura interessata. Per ottenere ciò bisogna collegare al metallo da proteggere un altro elemento costituito da un metallo sicuramente più anodico del precedente e tale per cui il potenziale misto che si viene a realizzare sia più elettronegativo del potenziale di protezione richiesto. È chiaro che un anodo galvanico deve avere un potenziale molto più anodico di quello del metallo da proteggere e deve inoltre essere in grado di liberare una elevata quantità di ioni per assicurare una adeguata circolazione di corrente.